XÂY DỰNG MÔ HÌNH TÁI CHẾ PIN LITHIUM BẰNG PHƯƠNG PHÁP HỎA LUYỆN
XÂY DỰNG MÔ HÌNH TÁI CHẾ PIN LITHIUM
BẰNG PHƯƠNG PHÁP HỎA LUYỆN
Modelling of lithium-ion battery recycling by pyrometallurgy method
NGUYỄN CHU BẢO LONG, NGUYỄN HÒA AN và ĐỖ VĂN QUẢNG*
Viện Khoa học và Công nghệ Mỏ - Luyện kim, 79 An Trạch, Đống Đa, Hà Nội
*Email: dovanquang@vimluki.vn
TÓM TẮT
Bài báo nghiên cứu xây dựng mô hình công nghệ tái chế pin lithium bằng phương pháp hỏa luyện trong lò điện hồ quang. Pin sau khi thu gom từ các nguồn pin thải đã qua sử dụng được xả điện, tháo dỡ, phân loại thủ công, sau đó vật liệu điện cực được nghiền thành bột mịn và vê viên trước khi tiến hành nấu luyện trong lò hồ quang điện ở nhiệt độ 1600oC. Hai thí nghiệm được thực hiện, mỗi thí nghiệm được sử dụng một hệ xỉ khác nhau là hệ xỉ CaO - SiO2 và CaO – Al2O3. Kết quả thí nghiệm cho thấy quá trình hỏa luyện đề xuất có thể tạo ra hợp kim Co – Ni – Mn, việc sử dụng hệ xỉ CaO – Al2O3 mang lại hiệu suất thu hồi kim loại cao hơn lên đến hơn 99%. Bên cạnh đó, xỉ CaO – Al2O3 có giá trị thương mại, được tạo ra như một sản phẩm phụ tiềm năng góp phần nâng cao tính kinh tế cho quy trình tái chế được đề xuất.
Từ khóa: Tái chế pin ion - lithium, quy trình hỏa luyện, thu hồi Co.
ABSTRACT
This article studies the modelling of lithium-ion battery recycling by pyrometallurgy using electric arc furnace. Batteries, after being collected from waste sources, were discharged, manually dismantled, sorted, then the resulting electrode materials were milled into fine powder and pelleted before being smelted at a temperature of 1600oC. Two experiments were conducted with two slag systems CaO – SiO2 and CaO – Al2O3 were employed. Experimental results showed that the proposed pyrometallurgical process could create Co - Ni - Mn alloy. Furthermore, employing the CaO - Al2O3 slag system provided higher metal recovery efficiency up to more than 99%. In addition, the CaO – Al2O3 slag system was generated as a potential by-product that contributes to improving the economic viability of the proposed pyrometallurgical recycling process.
Keywords: Lithium-ion battery recycling, pyrometallurgy, Co recovery.
1. ĐẶT VẤN ĐỀ
Pin lithium-ion (LIB) được sử dụng rộng rãi trong các thiết bị cầm và gần đây là trong xe điện do hiệu suất điện vượt trội của chúng [1–4]. Năm 2010, lượng pin lithium-ion được đưa ra thị trường toàn cầu chỉ là 140.000 tấn, tăng vọt lên 1.320.000 tấn vào năm 2019 và dự kiến là 4.150.000 tấn vào năm 2025 [5]. Do tuổi thọ của LIB tương đối ngắn (thường là 3–5 năm), nên số lượng LIB đã qua sử dụng trong tương lai sẽ rất lớn và việc tái chế LIB là bắt buộc để duy trì nền kinh tế tuần hoàn cho sản xuất pin. Mặt khác, việc tái chế LIB có thể làm giảm ô nhiễm môi trường tiềm ẩn do xử lý không đúng cách LIB đã qua sử dụng, có chứa các thành phần độc hại và dễ cháy như niken, coban và chất điện phân [1, 2, 6–8].
Nhìn chung, quy trình tái chế đối với LIB đã qua sử dụng có thể được phân loại thành 2 quy trình chính là thủy luyện và hỏa luyện. Quy trình thủy luyện khá phổ biến ở quy mô phòng thí nghiệm [5, 9, 10], việc triển khai các công nghệ này trên quy mô công nghiệp vẫn còn bỏ ngỏ [4, 5]. Trong khi đó, ở quy mô công nghiệp thì quy trình hỏa luyện được sử dụng nhiều hơn [4, 5]. Bên cạnh đó, quy trình tái chế thủy luyện có ưu điểm là tính chọn lọc cao, tiêu thụ năng lượng thấp, sản xuất các sản phẩm giá trị gia tăng, v.v. , trong khi đó các quy trình hỏa luyện có ưu điểm là quy trình đơn giản, khả năng mở rộng quy mô và tính linh hoạt cao áp dụng cho nhiều loại pin khác nhau [4, 7].
Bài báo này trình bày các kết quả nghiên cứu bằng quy trình hỏa luyện (sử dụng lò điện hồ quang) áp dụng tại Viện Khoa học và Công nghệ Mỏ - Luyện kim. Quá trình nghiên cứu tập trung vào việc thu hồi Co, Ni và Mn từ vật liệu LIB.

2.1. Chuẩn bị nguyên liệu
Pin sử dụng cho nghiên cứu là pin điện thoại (Samsung và Iphone) được thu gom tại các cửa hàng sửa chữa điện thoại di động vẫn còn chứa một lượng năng lượng nhất định, tiềm ẩn nguy cơ cháy nổ cao trong quá trình sơ chế nên cần xả điện trước khi tiến hành xử lí cơ học. Để tiến hành xả điện, LIB được ngâm trong dung dịch muối NH4Cl để tạo môi trường điện li trong khoảng từ 6 – 8 giờ cho đến khi không thấy bọt khí nổi lên nữa. LIB sau đó được sấy ở 80oC trong 4 giờ để làm bay hơi hết các chất điện phân,…
Sau khi xả điện dư, việc tháo và phân loại các thành phần pin được thực hiện thủ công. Vật liệu dùng cho nghiên cứu là điện cực anốt và catốt của LIB như được trình bày ở hình 2a. Vật liệu catốt và anốt sau khi tháo dỡ sẽ được nghiền nhằm thu được dạng bột (gọi là bột điện cực). Bột điện cực được bổ sung chất dính (khoảng 1,5% khối lượng) và được vê viên bằng máy vê viên. Các viên nguyên liệu sau vê viên được sấy ở nhiệt độ 80oC trong 4 giờ để đảm bảo nguyên liệu khô (hình 2b).

2.2. Phối liệu
Vật liệu điện cực sau khi vê viên được phân tích thành phần bằng phương pháp ICP tại Viện Khoa học và Công nghệ Mỏ - Luyện kim, kết quả ở bảng 1.

Quá trình nghiên cứu được thực hiện bằng 2 thí nghiệm:
- Thí nghiệm 1: nhằm tạo ra hợp kim kim loại dưới dạng ferro, sử dụng hệ xỉ
CaO – SiO2, thành phần phối liệu được trình bày ở bảng 2.
- Thí nghiệm 2: nhằm tạo ra một dạng thép hợp kim, sử dụng hệ xỉ CaO – Al2O3, thành phần phối liệu được trình bày ở bảng 2.

2.3. Nấu luyện
Quy trình nấu luyện được thực hiện ở lò điện hồ quang (EAF) một cực, cả hai thí nghiệm được thực hiện như sau:
- Nạp liệu trong EAF: Khi bắt đầu mỗi mẻ, thép vụn và chất tạo xỉ được nạp vào lò.
- Nấu chảy liệu trong EAF: Khi các vật liệu trong lò nóng chảy hoàn toàn thì tiến hành bổ sung viên điện cực từ từ cho tới khi hết ở nhiệt độ khoảng 1600 oC.
- Giữ nhiệt: Sau khi hoàn tất nạp liệu, lò được giữ nhiệt ở 1600 oC trong vòng
20 – 30 phút, sau đó tắt lò. Sản phẩm nấu luyện được làm nguội cùng lò.
3. KẾT QUẢ VÀ THẢO LUẬN
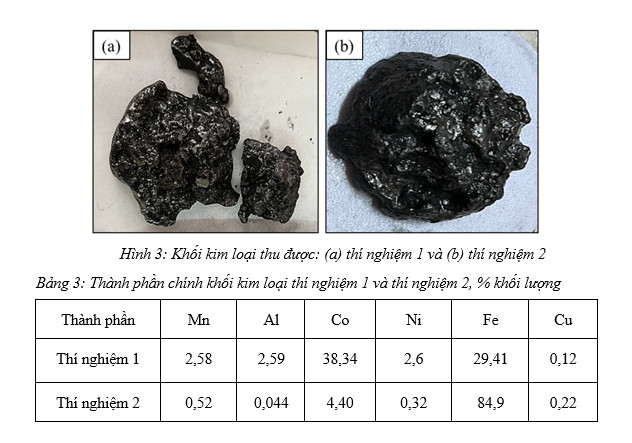
Khối kim loại thu được là 865,6 g ở thí nghiệm 1 và 1851 g ở thí nghiệm 2 như được trình bày ở hình 3, thành phần của 2 khối kim loại được thể hiện ở bảng 3 cho thấy khả năng thu hồi kim loại ở LIB ở cả 2 dạng hợp kim ferro hoặc trực tiếp ra thép hợp kim chứa Co và Ni là hoàn toàn khả thi. Ở thí nghiệm 2, hàm lượng Co được khống chế theo mác hợp kim A605 (ASTM) là đạt yêu cầu, các nguyên tố hợp kim khác thiếu có thể bổ sung trực tiếp bằng kim loại sạch hoặc dưới dạng ferro.
Hiệu suất thu hồi của các nguyên tố kim loại chính như Co; Ni và Mn được tính toán và trình bày ở bảng 4. Kết quả cho thấy việc thay đổi hệ xỉ đã tăng hiệu suất thu hồi kim loại trong LIB lên đáng kể, đặc biệt đối với Mn và Co.

Bảng 5 trình bày thành phần hóa học của xỉ EAF từ 2 thí nghiệm. Kết quả phân tích cho thấy lượng kim loại như Co; Ni và Mn đi vào xỉ ở thí nghiệm 2 là thấp hơn rất nhiều so với thí nghiệm 1. Nhìn chung, ở thí nghiệm 1 sử dụng hệ xỉ CaO–SiO2 là không phù hợp, lượng Al còn lại trong kim loại khá nhiều và hiệu suất thu hồi Mn, Ni và Co đều thấp hơn nhiều so với hệ xỉ ở thí nghiệm 2 (hình 4).

Việc ứng dụng hệ xỉ CaO–Al2O3 có thể giảm lượng xỉ do có khả năng trung hòa alumina có nguồn gốc từ vật liệu điện cực lớn hơn. Mặt khác, sử dụng xỉ CaO–Al2O3 làm giảm khả năng hòa tan của Li2O trong xỉ do ái lực của Li2O với Al2O3 yếu hơn so với SiO2. Việc tạo ra xỉ CaO–Al2O3 có thể cải thiện tính kinh tế của quy trình thu hồi hiện tại, vì xỉ CaO–Al2O3 (được gọi là canxi aluminat) là một khoáng chất có thể sử dụng làm xỉ tổng hợp trong quá trình luyện kim [11] và làm nguyên liệu cho ngành xi măng [12].

4. KẾT LUẬN
Kết quả cho thấy thí nghiệm 2 với hệ xỉ CaO-Al2O3 có hiệu suất thu hồi kim loại cao hơn nhiều so với thí nghiệm 1 sử dụng hệ xỉ CaO-SiO2. Hơn nữa, hệ xỉ CaO–Al2O3 có tính thương mại như một sản phẩm phụ tiềm năng, có thể mang lại thêm lợi ích cho quy trình được đề xuất. Quá trình thu hồi hỏa luyện được đề xuất có thể thu hồi kim loại từ LIB dưới dạng hợp kim Co–Ni–Mn hoặc dạng ferro. Hiệu suất thu hồi kim loại Co, Ni và Mn của thí nghiệm 2 lần lượt là 85,1%; 99,1% và 98,2%.
Việc thu hồi Co, Ni, Mn và Li từ các LIB đã sử dụng có thể duy trì việc sản xuất các LIB mới và giảm việc sử dụng các nguồn tài nguyên nguyên sinh.
TÀI LIỆU THAM KHẢO
[1] H. Pinegar, Y.R. Smith, Recycling of end-of-life lithium ion batteries, Part I: commercial processes, J. Sustain. Metall. 5 (2019) 402–416.
[2] G. Harper, R. Sommerville, E. Kendrick, L. Driscoll, P. Slater, R. Stolkin, A. Walton, P. Christensen, O. Heidrich, S. Lambert, A. Abbott, K. Ryder, L. Gaines, P. Anderson, Recycling lithium-ion batteries from electric vehicles, Nature 575 (2019) 75–86.
[3] A. Sonoc, J. Jeswiet, V.K. Soo, Opportunities to improve recycling of automotive lithium ion batteries, Procedia CIRP 29 (2015) 752–757.
[4] C. Liu, J. Lin, H. Cao, Y. Zhang, Z. Sun, Recycling of spent lithium-ion batteries in view of lithium recovery : a critical review, J. Clean. Prod. 228 (2019) 801–813.
[5] H.E. Melin, State-of-the-art in reuse and recycling of lithium-ion batteries – a research review, 2019.
[6] X. Zheng, Z. Zhu, X. Lin, Y. Zhang, Y. He, H. Cao, Z. Sun, A mini-review on metal recycling from spent lithium ion batteries, Engineering 4 (2018) 361–370.
[7] B.D.H. Knights, F. Saloojee, Lithium battery recycling, 2015.
[8] N.P. Lebedeva, F. Di Persio, T. Kosmidou, D. Dams, A. Pfrang, A. Kersys, L. BoonBrett, Amount of free liquid electrolyte in commercial large format prismatic Li-ion battery cells, J. Electrochem. Soc. 166 (2019) A779–A786.
[9] J. Xu, H.R. Thomas, R.W. Francis, K.R. Lum, J. Wang, B. Liang, A review of processes and technologies for the recycling of lithium-ion secondary batteries, J. Power Sources 177 (2008) 512–527.
[10] X. Zeng, J. Li, N. Singh, Recycling of spent lithium-ion battery: a critical review, Crit. Rev. Environ. Sci. Technol. 44 (2014) 1129–1165.
[11] A. Chakrabarti, Steel Making, PHI Learning Pvt. Ltd, 2006.
[12] K.L. Scrivener, J.L. Cabiron, R. Letourneux, High-performance concretes from calcium aluminate cements, Cement Concr. Res. 29 (1999) 1215–1223.
- Bán thanh lý tài sản cố định, công cụ dụng cụ
- Thông báo lần 2. Bổ sung nhân sự cho Phòng Kế hoạch và Khoa học Công nghệ
- Nhu cầu bổ sung nhân sự cho Phòng Kế hoạch và Khoa học Công nghệ (C2), Viện Khoa học và Công nghệ Mỏ - Luyện kim
- KẾ HOẠCH Thực hiện công tác phòng, chống tham nhũng, tiêu cực năm 2025 của Viện Khoa học và Công nghệ Mỏ - Luyện kim
- KẾ HOẠCH Thực hiện Chương trình thực hành tiết kiệm, chống lãng phí năm 2025 của Viện Khoa học và Công nghệ Mỏ - Luyện kim
-
Kỷ niệm 45 năm thành lập VIMLUKI
- Toàn cảnh Lễ kỷ niệm 55 năm ngày thành lập Viện Khoa học và Công nghệ Mỏ - Luyện kim
- Hiệp hội Titan Việt Nam
- Phóng sự: 55 năm thành lập VIMLUKI
- Phóng sự: 50 năm thành lập Vimluki
- Highlight lễ kỷ niệm 55 năm thành lập Viện
- Kỷ niệm 40 thành lập Vimluki (p1)
- Kỷ niệm 40 thành lập Vimluki (p2)